Ionenkanäle sind von großer Bedeutung, wenn es darum geht, Informationen zwischen lebenden Zellen weiterzuleiten oder Funktionen wie die Herzfrequenz zu steuern. Forscher am Max-Planck-Institut für biophysikalische Chemie und an der Universität Göttingen haben mit britischen Kollegen nun aufgeklärt, was Kaliumkanäle zu hocheffizienten Filtern macht. Wie sie herausfanden, liegt dem sehr schnellen Durchtritt der Ionen – anders als bisher gedacht – ein rein physikalisches Prinzip zugrunde. Die Ergebnisse der Forscher stellen das bisherige Wissen zur Funktionsweise solcher Kanäle auf den Kopf und helfen zu verstehen, warum bestimmte genetische Veränderungen des Kaliumionenkanals zu Krankheiten wie Herzrhythmusstörungen führen können.
(Science, 17. Oktober 2014)
Was wir fühlen, denken oder in unserem Gedächtnis abrufen, geht mit einem Feuerwerk elektrischer Impulse einher, über die zahlreiche Nervenzellen in unserem Gehirn miteinander kommunizieren. Ionenkanäle – winzige Poren in der Zellmembran – sind dabei lebenswichtige Akteure. Auf bestimmte Reize hin öffnen oder schließen sie sich und lassen nur bestimmte Teilchen in die Zelle hinein- oder hinausströmen. Unter den Ionenkanälen stellen Kaliumkanäle die vermutlich größte Familie dar. Sie sind nicht nur daran beteiligt, Signale zwischen Nervenzellen in unserem Gehirn weiterzuleiten, sondern kontrollieren auch die Frequenz unseres Herzschlags oder steuern das Zellvolumen. Kein Wunder, dass man Kaliumkanäle daher in den Membranen fast aller Zelltypen unseres Körpers findet.
Kaliumkanäle funktionieren als hoch effiziente Filter. Ihre engste Stelle im Kanal, der sogenannte Selektivitätsfilter, sorgt dafür, dass nur Kaliumionen mit ihrer charakteristischen Größe und Ladung passieren können. Ihr Durchtritt durch die Pore verläuft rasend schnell. Forschern um Bert de Groot am Max-Planck-Institut für biophysikalische Chemie in Göttingen ist es jetzt zusammen mit Kollegen an den Universitäten Göttingen, Dundee und Oxford gelungen, das grundlegende physikalische Prinzip aufzuklären, das den immens schnellen Durchstrom der Kaliumionen durch den Kanal ermöglicht.
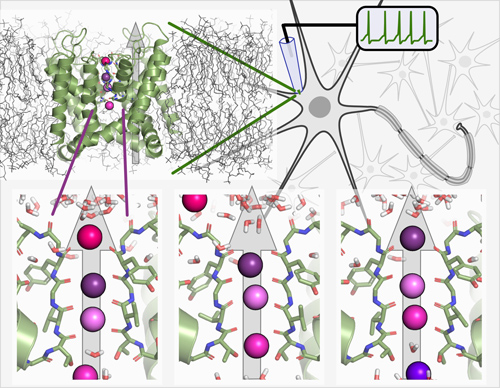
Mithilfe moderner Computersimulationen gelang es dem Team um Bert de Groot, den schnellen Durchtritt der Kaliumionen durch den Kaliumkanal darzustellen, der in der Hüllmembran lebender Zellen sitzt. Überraschenderweise ist der Kanal in der Lage, die Ionen trotz ihrer starken elektrostatischen Abstoßungskräfte direkt hintereinander zu leiten und nicht – wie lange Zeit angenommen – mit Wassermolekülen zwischen den Ionen. Image credit: © David Köpfer, Bert de Groot; Max-Planck-Institut für biophysikalische Chemie
„Dieser Mechanismus funktioniert völlig anders als bisher gedacht“, erklärt der Chemiker de Groot. Mithilfe einer Vielzahl von aufwendigen Computersimulationen schaute sein Team am Göttinger Max-Planck-Institut für biophysikalische Chemie den Kaliumkanälen direkt „bei ihrer Arbeit“ zu. „Unser Filmclip zeigt, dass die Kaliumionen im Selektivitätsfilter des Ionenkanals wie auf Perlen aufgereiht sehr eng beieinander sitzen – so dicht, dass sich ihre Ladungen gewaltig abstoßen“, sagt de Groot. Weniger als ein millionstel Millimeter sind sie voneinander entfernt. Balanciert wird diese Abstoßung durch anziehende Wechselwirkungen mit dem Kanal.
Diese feine Balance wird empfindlich gestört, wenn ein neues Kaliumion in den Kanal eintritt. Laut de Groot ist dies der Tropfen, der das Fass zum Überlaufen bringt. Denn jetzt überwiegt, dass sich die Ladungen der Kaliumionen abstoßen und das Kaliumion, das am nächsten zum Ausgang sitzt, wird hinausgedrängt. „Es ist ein wenig, als ob das hinausgedrängelte Ion auf einer elektrostatischen Welle reitet, die durch durch das einkommende Ion ausgelöst wird. Wir bezeichnen dies als Ladungs-Knock-on-Mechanismus“, ergänzt David Köpfer, Doktorand in de Groots Forschungsgruppe. „Niemand hatte vorher geglaubt, dass sich die Kaliumionen im Kanal überhaupt so nahe kommen können. Bisher ging man davon aus, dass Wassermoleküle dazwischen sitzen und dadurch Durchtritt der Kaliumionen durch den Kanal beschleunigen“. Doch wie das internationale Forscherteam herausfand, hat Wasser genau den gegenteiligen Effekt. Es bremste den Transport der Ionen sogar.
Um diesen überraschenden Befund mit experimentellen Ergebnissen zu vergleichen, analysierten Tim Gruene und George M. Sheldrick von der Universität Göttingen vorliegende Daten zur Struktur des Kaliumkanals. Für die Leistung, die dreidimensionale Form dieses komplexen Proteinkanals aufzuklären, erhielt der amerikanische Biochemiker und Mediziner Roderick MacKinnon im Jahr 2003 den Nobelpreis für Chemie. „Mithilfe der fortgeschrittenen Programme von George Sheldrick und der kristallografischen Expertise an der Universität Göttingen konnten wir die vorhandenen kristallografischen Datenviel genauer auswerten als bisher“, sagt Gruene. „Wir haben damit einen sehr detaillierten ‚Schnappschuss’ des Selektivitätsfilters erhalten. Und wie unsere Kollegen in ihren Simulationen sehen auch wir, dass die Kaliumionen im Selektivitätsfilter sehr eng beieinander sitzen“, bestätigt Sheldrick.
Das Ergebnis des Forscherteams, das in der aktuellen Ausgabe der Fachzeitschrift Science veröffentlicht ist, stellt das bisherige Wissen zur Funktionsweise solcher Kaliumkanäle auf den Kopf. „Der neu entdeckte Ladungs-Knock-on-Mechanimus scheint sehr früh in der Evolution entstanden und damit universell zu sein“, erklärt Ulrich Zachariae, Forschungsgruppenleiter an der Universität Dundee. „Und vermutlich funktionieren viele Kaliumkänale nach diesem grundlegenden physikalischen Prinzip“.
Ein detailliertes Verständnis der Funktion von Ionenkanälen ist auch entscheidend, um Antworten auf wichtige medizinische Fragen zu erhalten. „Wenn wir den molekularen Mechanismus kennen, der den extrem schnellen Durchstrom der Kaliumionen durch den Kanal ermöglicht, können wir zukünftig auch sehr viel besser verstehen, warum sich bestimmte genetische Veränderungen des Ionenkanals so fatal auswirken und zu Krankheiten wie Herzrhythmusstörungen führen können“, so de Groot. (cr)
*Source: Max-Planck-Institut für biophysikalische Chemie
