Freiburger Forscher entschlüsseln Mechanismen, mit denen Tumore bei Stress ihr eigenes Wachstum fördern
Ein Enzym, das Tumorwachstum fördert, sammelt sich in gestressten Krebszellen verstärkt an. Das hat die Gruppe des Freiburger Molekularmediziners Prof. Dr. Thomas Reinheckel zusammen mit der Freiburger Biochemikerin Prof. Dr. Sabine Rospert sowie mit Prof. Dr. Elmar Stickeler und Dr. Peter Bronsert vom Universitätsklinikum Freiburg herausgefunden. Das Team hat die Forschungsergebnisse in der Fachzeitschrift „Journal of Biological Chemistry“ veröffentlicht.
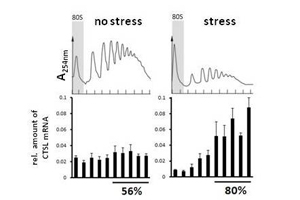
Wenn eine Krebszelle Stress ausgesetzt ist, steigt der Spiegel von Cathepsin-L-mRNA. Foto credit: Dr. Martina Tholen / Arbeitsgruppe Reinheckel
Wenn ein Tumor beginnt Metastasen zu streuen, um neue Tumore an anderen Stellen zu bilden, ist dies für ihn eine kritische Phase in der Entwicklung. Dieser Prozess bedeutet für Krebszellen Stress, denn der Wirtskörper versorgt große Tumore währenddessen mangelhaft mit Nährstoffen und Sauerstoff. Viele Krebszellen stellen daher die Produktion von neuen Proteinen ein und schaffen es nicht, in einen metastasenbildenden Zustand zu wechseln. Einige jedoch sind trotzdem in der Lage, bestimmte Enzyme herzustellen, die ihr weiteres Wachstum und die Bildung von Metastasen fördern.
Das Protein, das die Wissenschaftlerinnen und Wissenschaftler in ihrer Studie untersucht haben, ist die Protease Cathepsin L. Wenn bei Brustkrebs-Patientinnen ein hoher Spiegel dieses Enzyms vorliegt, vergrößert dies die Häufigkeit, dass sich Metastasen bilden, und die Überlebensrate verringert sich. Stressbedingungen veranlassen Tumorzellen dazu, die Produktion der meisten Proteine herunterzufahren. Auf diese Weise sparen sie Energie, vor allem indem sie die energieintensive Umwandlung des in der mRNA kodierten Bauplans in das entsprechende Protein hemmen. Die Wissenschaftler stellten jedoch fest: Auch wenn Krebsgewebe und -zellen von Mäusen und Menschen erhöhten Stressbedingungen ausgesetzt waren, blieb ein hoher Spiegel von Cathepsin L in ihnen erhalten.
Um den Grund dafür herauszufinden, untersuchte das Forschungsteam die Verbindung von verschiedenen mRNA zu so genannten Polyribosom-Komplexen. Die Komplexe bestehen aus mRNA und mehreren Ribosomen, die Proteine aus der mRNA herstellen. Diese Fließband-Fertigung stellt sicher, dass aus einem einzigen mRNA-Molekül eine große Proteinmenge effizient hergestellt werden kann. Die Forschenden zeigten, dass die Cathepsin-L-mRNA durchgehend mit den Polyribosom-Komplexen verbunden ist – auch unter Stressbedingungen, wenn die Produktion anderer Proteine eingestellt wurde. Dieser Vorteil von Cathepsin-L-mRNA schien davon abzuhängen, wo in der Zelle sich Cathepsin L befindet. In einer gestressten Zelle formen sich bestimmte Ansammlungen von inaktiven Proteinen und mRNA, denen die Cathepsin-L-mRNA ausweicht und so zur Proteinsynthese zur Verfügung steht.
Thomas Reinheckel leitet eine Forschungsgruppe am Institut für Molekulare Medizin und Zellforschung der Universität Freiburg. Sabine Rospert ist Abteilungsleiterin am Institut für Biochemie und Molekularbiologie der Albert-Ludwigs-Universität. Reinheckel und Rospert sind Mitglieder des Freiburger Exzellenzclusters BIOSS Centre for Biological Signalling Studies. Elmar Stickeler ist Ärztlicher Leiter des Brustzentrums Freiburg und Leitender Oberarzt an der Klinik für Frauenheilkunde des Universitätsklinikums Freiburg. Peter Bronsert ist Assistenzarzt am Institut für Klinische Pathologie des Universitätsklinikums Freiburg.
Originalpublikation:
Martina Tholen, Julia Wolanski, Britta Stolze, Marco Chiabudini, Mieczyslaw Gajda, Peter Bronsert, Elmar Stickeler, Sabine Rospert, and Thomas Reinheckel (2015). Stress-resistant Translation of Cathepsin L mRNA in Breast Cancer Progression. Journal of Biological Chemistry 290.25.
*Source: Universität Freiburg
