Seit einigen Jahren werden Metallverbindungen erfolgreich als Chemotherapeutika zur Bekämpfung bestimmter Krebsarten eingesetzt – am häufigsten Platinverbindungen. Bei der Suche nach neuen, wirksameren Antitumormitteln steht oft das fehlende Verständnis der zugrundeliegenden molekularen Mechanismen in diesen Metallverbindungen im Wege. Ein internationales Forschungsteam um Leticia González von der Universität Wien hat nun ein Verfahren entwickelt um die Wechselwirkung von Metallverbindungen mit dem zellulären Erbgut zu beobachten.
Im Kampf gegen Krebs werden jedes Jahr tausende von chemischen Verbindungen entwickelt und auf ihre potenzielle Wirksamkeit gegen Tumore untersucht. Findet man eine solche Wirksamkeit, dauert es meistens jedoch viele Jahre, bis ein neuer Wirkstoff als tatsächliches Medikament zugelassen wird und bei PatientInnen eingesetzt werden kann. Der Prozess der Zulassung dauert unter anderem deswegen so lange, weil es in der Regel sehr schwierig ist, den Weg eines Wirkstoffs innerhalb der menschlichen Zellen zu verfolgen. Infolgedessen lassen sich mögliche Nebenwirkungen nur schwer vorhersagen und müssen durch aufwändige Experimente erforscht werden.
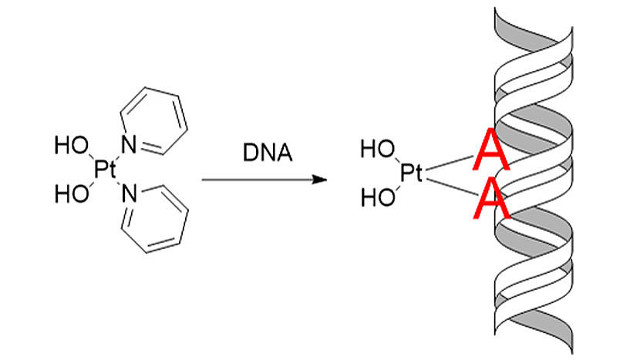
In der Zelle angekommen, bindet der Wirkstoff Pt103 bevorzugt an die Nukleobase Adenin, einem der Bausteine des Erbguts (Image copyright: Juan J. Nogueira, Universität Wien).
Die Arbeitsgruppe von Leticia González von der Fakultät für Chemie der Universität Wien hat nun, in Zusammenarbeit mit der Forschungsgruppe von Jacinto Sá von der Universität Uppsala sowie weiteren internationalen Partnern, ein Protokoll entwickelt, mit dem sich die Wechselwirkung metallhaltiger Medikamente mit Biomolekülen innerhalb eines Organismus mit hoher Genauigkeit verfolgen lässt. “In einem ersten Schritt haben wir mit Hilfe speziell erzeugter Röntgenstrahlen jenen Ort bestimmt, an dem das Medikament innerhalb der Zelle andockt”, erklärt González. In einem zweiten Schritt haben die ForscherInnen mittels aufwändiger Computersimulationen, welche teilweise am Supercomputer “Vienna Scientific Cluster” durchgeführt wurden, den Grund für die Bevorzugung dieses bestimmten Ortes aufgeklärt.
Den WissenschafterInnen ist es bereits gelungen, dieses Protokoll erstmals bei einem Medikament anzuwenden, dessen Antitumorwirkung bekannt, der genaue Wirkmechanismus aber noch nicht geklärt ist. Von der Verbindung “Pt103” aus der Familie der platinhaltigen Wirkstoffe ist bereits aus vorangegangenen Studien eine Antitumorwirkung bekannt. Bisher vermuteten ForscherInnen, dass die Substanz mit dem Erbgut der Zelle wechselwirkt und dadurch die Weitergabe des genetischen Codes während der Zellteilung stört. “Wir konnten zeigen, dass der Wirkstoff an eine ganz spezielle, für uns unerwartete Stelle andockt und gleichzeitig klären, warum genau diese spezifischen Stellen angegriffen werden”, so Juan J. Nogueira, Postdoc in der Gruppe von González und Co-Autor der Studie. Dank dieser Erkenntnis lässt sich die Funktionalität der Chemotherapeutika besser verstehen und kann zur Entwicklung neuer, effizienterer Wirkstoffe beitragen.
Publikation in “Journal of Physical Chemistry Letters”
“Direct Determination of Metal Complexes Interaction with DNA by Atomic Telemetry and Multiscale Molecular Dynamics.” Joanna Czapla-Masztafiak, Juan J. Nogueira, Ewelina Lipiec, Wojciech M. Kwiatek, Bayden R. Wood, Glen B. Deacon, Yves Kayser, Daniel L. A. Fernandes, Mariia V. Pavliuk, Jakub Szlachetko, Leticia González, and Jacinto Sá
The Journal of Physical Chemistry Letters 2017, 8, 805-811.
DOI: 10.1021/acs.jpclett.7b00070
*source: Universität Wien
